〜終わり〜
■ぜひアンケートにご協力下さい■


燃料電池は燃料から直接に電気エネルギーを取り出すことができ、化石燃料を燃焼させる従来の発電システムに比べて、高い発電効率、優れた環境特性、排熱利用による高い総合効率、量産による低コスト化の可能性などの特徴をもち、国内外で開発が進められている。
発電の原理は水の電気分解と逆の反応で、電解質を挟んだ二つの電極に酸素と水素を供給して電気と熱を発生させる。
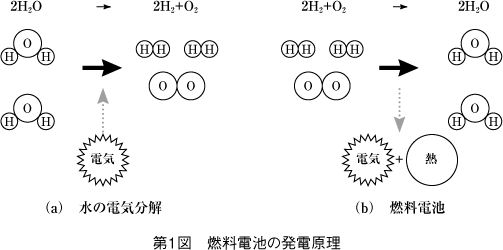

しかし、電解質に水素と酸素を単純においても反応は起こらない。反応を起こすためには高温や触媒の力を借りることになる。
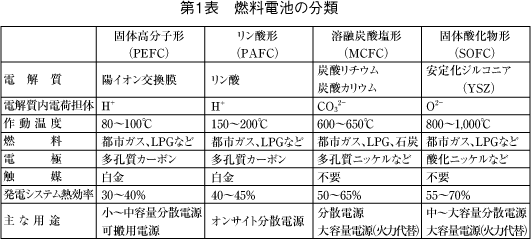
燃料電池は電解質の種類により第1表のように分類されている。

固体高分子形燃料電池は電解質にイオン交換膜の高分子膜を使用する燃料電池で宇宙開発用として開発された。現在は自動車用、家庭用コージェネレーション、携帯用など幅広い分野で開発が進められている。
主な特徴を以下に示す。
- 常温から発電ができ、始動特性に優れている。
- 作動温度が90℃程度のため、耐熱温度の低い安価な材料が使用できる。
- 電流密度が高いため、小型・軽量化が可能である。
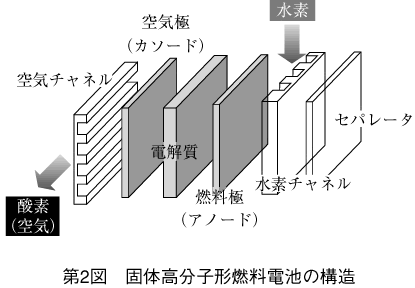
(1) 単セルの構造と動作原理
単セルは第2図に示すように電解質(高分子電解質膜)と燃料極(アノード)、空気極(カソード)という2枚の電極のサンドイッチ構造になっている。

第3図に動作原理を示す。
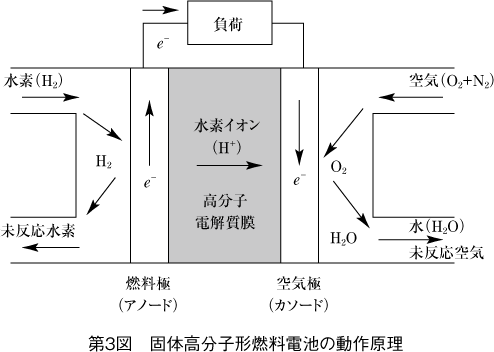

燃料極では水素が触媒の白金によって水素イオンと電子に分離される。
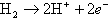
水素イオンは電解質を通して反対極の空気極へ移動し、電子は外部に抜け出し導線を伝って電流となる。
空気極には酸素が導入される。ここで電解質を通って入ってきた水素イオンと外部の導線を経由してきた電子との反応で水が生成される。
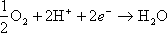
両極での反応を総合すると、
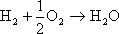
の化学式になり、水の電気分解の逆反応が成立していることが分かる。
単セルを挟み込むように配置されたセパレータは、炭素板や導電性の樹脂でできている。水素や酸素はその表面に加工された細かい溝を通って均等に電極へ供給される。
単セルの電池電圧は通常0.6〜0.8V程度なので、システム上必要な電圧を得るためには単セルを何段か繰り返し重ね(積層化)、スタックを構成する。
(2) 白金触媒の被毒
90℃前後の低温度動作なので触媒が必要である。触媒としては白金が使用される。白金系触媒は、一酸化炭素と非常に結合しやすく、結合した後は活性を失う、いわゆる触媒の被毒作用が起こる。燃料としてメタノール、ガソリンなどから水素を取り出す場合は一酸化炭素ガス濃度を許容レベル(例えば10ppm)まで下げる改質が行われる。改質法としては水蒸気改質法と部分酸化法がある。
リン酸形燃料電池は電解質としてリン酸(H3PO4)水溶液を用い、動作温度は約200℃であり、白金が触媒として使われる。
主に都市ガスを燃料としてビルの電力と冷暖房、給湯を賄うオンサイト形コージェネレーションシステムとして運転されている。
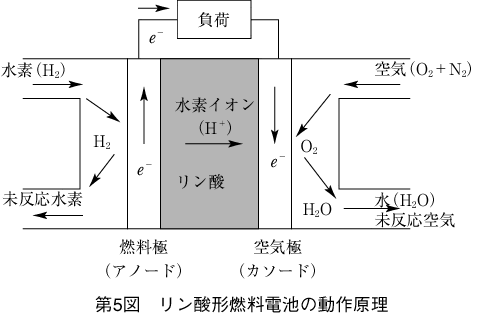
(1) 単セルの構造と動作原理
単セルの構造を第4図に示す。
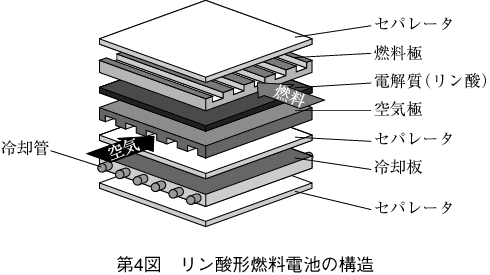

燃料極、空気極、電解質が厚さ数mmの板上に圧縮された構造になっており、燃料極、空気極の二つの電極は、ガスを通しやすいように無数の穴が開いた多孔質の素材でつくられている。
動作原理を第5図に示す。固体高分子形燃料電池と同様で、燃料極では水素が酸化され水素イオンと電子になり、空気極では空気中の酸素が還元されて水(水蒸気)ができる。

(2) 燃料改質器
白金の被毒対応として、燃料処理によって高純度の水素を電池本体に供給する必要がある。第6図に水蒸気改質法による燃料処理システムを示す。
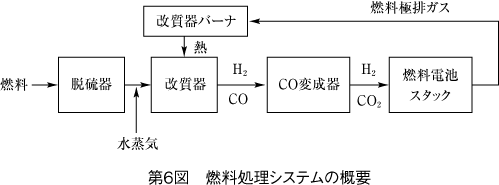

脱硫器、改質器、CO変換器から構成される。
通常天然ガスには微量に硫黄が含まれるので脱硫器によって処理され改質器に入る。水蒸気改質は触媒介在下で水蒸気を投入して行われる。メタンの場合で示すと、
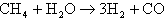
の反応になる。この反応は吸熱反応で外部から熱を加える必要があり、熱は電池から戻る余剰水素を改質器バーナーで燃焼させることで供給される。
この反応でできた一酸化炭素は、次のCO変成器でシフト反応と呼ばれる反応によって炭酸ガスに変換される。
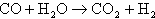
前述の式と合わせた燃料改質全体の反応は次式となる。
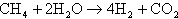
溶融炭酸塩形燃料電池は水素イオンの代りに炭酸イオン(CO32-)を用い、溶融した炭酸塩を電解質としている。そのため水素のほかに天然ガスや石炭ガスを燃料とすることが可能である。
動作温度は600〜700℃程度と高く、高温動作であるため、高価な触媒が不要、燃料改質が簡素、発電効率が高い、高温排ガスをガスタービンなどの熱源として使用でき、最終的には大規模な石炭ガス化燃料電池複合発電プラントなどの用途が期待されている。
(1) 単セルの構造と動作原理
単セルの構成を第7図に示す。
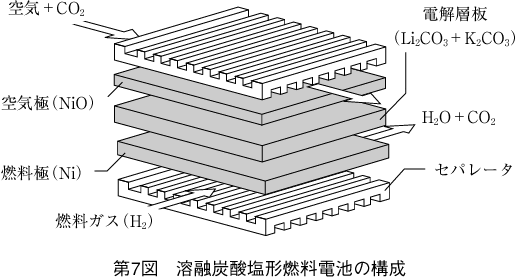

単セルは電気伝導性多孔質の燃料極、空気極と溶融炭酸塩を保持する電解質板で構成される。電解液はアルカリ金属炭酸塩、通常は炭酸リチウム(Li2CO3)と炭酸カリウム(K2CO3)の混合塩を用いる。この混合塩は約490℃で溶融状態になり、炭酸イオンの優れた導電体になる。
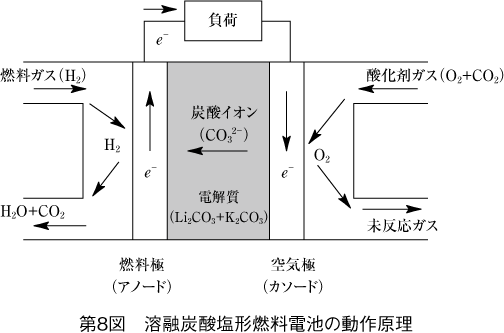

空気極では酸素と炭酸ガスと電子が電解液膜で電気化学的に反応して炭酸イオンとなり、電解質を移動する。
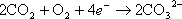
一方、燃料極では水素が電解液を移動してきた炭酸イオンと反応し、水、炭酸ガス、電子を生成する。
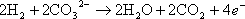
全体の反応をまとめると水素と酸素から水を生成する単純な反応となる。
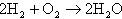
結局、炭酸ガスは酸素のキャリアの役割を果たしていることになる。
(2) 外部改質方式と内部改質方式
燃料の改質反応を改質器で行ってから水素を電池に供給する方式が外部改質方式で、この反応を電池の内部で行う方式が内部改質方式である。
内部改質方式のメリットは、
- 改質反応に必要な熱を電池の発電に伴う発熱を直接に利用できる。
- システムがコンパクトになる。
- 改質によって熱が吸収されるので、電池冷却に必要な動力を低減できる。
などである。
しかし、内部改質で副反応的に発生する一酸化炭素が白金を被毒するので、適用は高温形燃料電池に限定される。
更に、内部改質方式には改質触媒の位置によって直接方式と間接方式がある。
第9図にこれらの改質方式の構造及び動作原理を示す。
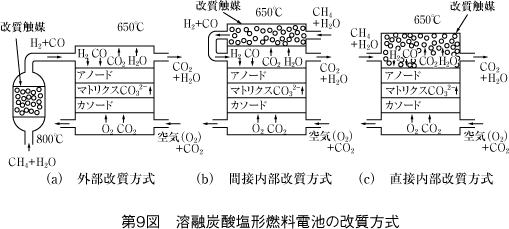

電解質として高温で酸素イオン導電性を示すセラミックであるイットリア安定化ジルコニア(YSZ)などの固体酸化物電解質を用い、700〜1,000℃程度の高温で運転される電池である。内部改質方式なので改質器は不要であり、触媒も必要ない。しかし、燃料及び空気を電池入口の温度まで予熱する高温熱交換器がシステムとして必要になる。
固体酸化物形燃料電池の特長として、電池全体がすべて固体でできており、システム構成が簡単であり、安定した性能と長寿命化が期待できる。また、高温の高品質な排熱を回収できるなどがあげられる。
(1) 単セルの構造
第10図に代表例を示す。すべて固体から構成されることから種々の形状が可能であり、平板型構造と円筒型構造に大別される。
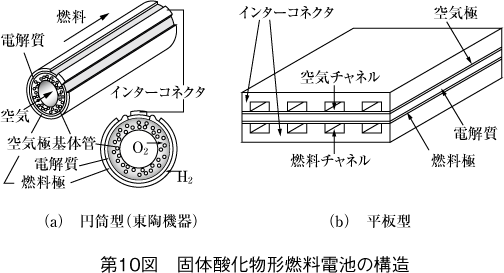

基本的にこれらの単セルがインターコネクタを介して連結する構造になる。ここで、インターコネクタとはほかの電池でのセパレータに対応するもので、固体酸化物形燃料電池ではこのように呼ばれることが多い。
(2) 単セルの動作原理
第11図に単セルの動作原理を示す。
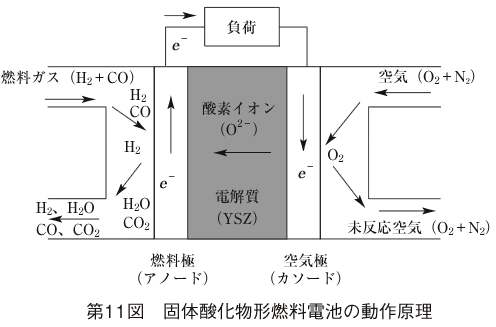

空気極では酸素と電子から酸素イオンが生成される。
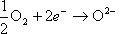
電解質が酸素イオン導電性なので、酸素イオンは電解質を透過し燃料極に向かう。燃料極では電池に送り込まれた天然ガスやDMEなどの燃料が、内部改質で水素と一酸化炭素に改質される。更に電解質を通ってきた酸素イオンと反応して電子と高温排気ガスを発生する。すなわち、次の反応が分かれて起こっている。
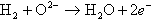
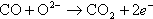
これらを総合して電池全体の反応は、
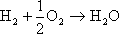
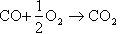
になり、水(蒸気)炭酸ガスが発生する。窒素の分離が不要なので、炭酸ガスは蒸気を凝縮させることで比較的容易に分離回収ができる。
- 固体高分子形燃料電池カタログ、東京ガス(株)
- 電中研レビュー、№51、(財)電力中央研究所
- Molten Carbonate Fuel Cell技術資料、溶融炭酸塩形燃料電池システム技術研究組合
- 関連技術資料、新エネルギー・産業技術総合開発機構
